Proceso termodinámico
En física, se denomina proceso termodinámico a la evolución de determinadas magnitudes (o propiedades) propiamente termodinámicas relativas a un determinado sistema termodinámico. Desde el punto de vista de la termodinámica, estas transformaciones deben transcurrir desde un estado de equilibrio inicial a otro final; es decir, que las magnitudes que sufren una variación al pasar de un estado a otro deben estar perfectamente definidas en dichos estados inicial y final. De esta forma los procesos termodinámicos pueden ser interpretados como el resultado de la interacción de un sistema con otro tras ser eliminada alguna ligadura entre ellos, de forma que finalmente los sistemas se encuentren en equilibrio (mecánico, térmico y/o material) entre sí.
De una manera menos abstracta, un proceso termodinámico puede ser visto como los cambios de un sistema, desde unas condiciones iniciales hasta otras condiciones finales, debido a la desestabilización del sistema.
Tipos de procesos termodinámicos
Procesos Iso
Son los procesos cuyas magnitudes permanecen "constantes", es decir que el sistema cambia manteniendo cierta proporcionalidad en su transformación. Se les asigna el prefijo iso-.
Ejemplo:
- Isotérmico: proceso a temperatura constante
- Isobárico: proceso a presión constante
- Isométrico o isocórico: proceso a volumen constante
- Isoentálpico: proceso a entalpía constante
- Isoentrópico: proceso a entropía constante
Procesos politrópicos
Los procesos politrópicos son aquellos procesos termodinámicos para gases ideales que cumplen con la ecuación:  donde
donde 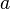 es un número dado. Para el caso de procesos adiabáticos,
es un número dado. Para el caso de procesos adiabáticos, 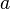 es igual a
es igual a 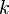 , el cual es un valor específico para cada sustancia. Este valor se puede encontrar en tablas para dicho caso
, el cual es un valor específico para cada sustancia. Este valor se puede encontrar en tablas para dicho caso
 donde
donde 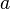 es un número dado. Para el caso de procesos adiabáticos,
es un número dado. Para el caso de procesos adiabáticos, 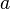 es igual a
es igual a 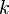 , el cual es un valor específico para cada sustancia. Este valor se puede encontrar en tablas para dicho caso
, el cual es un valor específico para cada sustancia. Este valor se puede encontrar en tablas para dicho casoTERMODINAMICA
La termodinamica puede definirse como el tema de la Física que estudia los procesos en los que se transfiere energía como calor y como trabajo.
Sabemos que se efectúa trabajo cuando la energía se transfiere de un cuerpo a otro por medios mecánicos. El calor es una transferencia de energía de un cuerpo a un segundo cuerpo que está a menor temperatura. O sea, el calor es muy semejante al trabajo.
El calor se define como una transferencia de energía debida a una diferencia de temperatura, mientras que el trabajo es una transferencia de energía que no se debe a una diferencia de temperatura.
Al hablar de termodinamica, con frecuencia se usa el término "sistema". Por sistema se entiende un objeto o conjunto de objetos que deseamos considerar. El resto, lo demás en el Universo, que no pertenece al sistema, se conoce como su "ambiente". Se consideran varios tipos de sistemas. En un sistema cerrado no entra ni sale masa, contrariamente a los sistemas abiertos donde sí puede entrar o salir masa. Un sistema cerrado es aislado si no pasa energía en cualquiera de sus formas por sus fronteras.
Previo a profundizar en este tema de la termodinamica, es imprescindible establecer una clara distinción entre tres conceptos básicos: temperatura, calor y energía interna. Como ejemplo ilustrativo, es conveniente recurrir a la teoría cinética de los gases, en que éstos sabemos están constituidos por numerosísimas moléculas en permanente choque entre sí.
La temperatura es una medida de la energía cinética media de las moléculas individuales. El calor es una transferencia de energía, como energía térmica, de un objeto a otro debida a una diferencia de temperatura.
La energía interna (o térmica) es la energía total de todas las moléculas del objeto, o sea incluye energía cinética de traslación, rotación y vibración de las moléculas, energía potencial en moléculas y energía potencial entre moléculas. Para mayor claridad, imaginemos dos barras calientes de un mismo material de igual masa y temperatura. Entre las dos tienen el doble de la energía interna respecto de una sola barra. Notemos que el flujo de calor entre dos objetos depende de sus temperaturas y no de cuánta energía térmica o interna tiene cada uno. El flujo de calor es siempre desde el objeto a mayor temperatura hacia el objeto a menor temperatura.
Primera Ley de la Termodinamica
Esta ley se expresa como:
Eint = Q - W
Cambio en la energía interna en el sistema = Calor agregado (Q) - Trabajo efectuado por el sistema (W)
Notar que el signo menos en el lado derecho de la ecuación se debe justamente a que W se define como el trabajo efectuado por el sistema.
Para entender esta ley, es útil imaginar un gas encerrado en un cilindro, una de cuyas tapas es un émbolo móvil y que mediante un mechero podemos agregarle calor. El cambio en la energía interna del gas estará dado por la diferencia entre el calor agregado y el trabajo que el gas hace al levantar el émbolo contra la presión atmosférica.
Segunda Ley de la Termodinamica
La primera ley nos dice que la energía se conserva. Sin embargo, podemos imaginar muchos procesos en que se conserve la energía, pero que realmente no ocurren en la naturaleza.
Sabemos que se efectúa trabajo cuando la energía se transfiere de un cuerpo a otro por medios mecánicos. El calor es una transferencia de energía de un cuerpo a un segundo cuerpo que está a menor temperatura. O sea, el calor es muy semejante al trabajo.
El calor se define como una transferencia de energía debida a una diferencia de temperatura, mientras que el trabajo es una transferencia de energía que no se debe a una diferencia de temperatura.
Al hablar de termodinamica, con frecuencia se usa el término "sistema". Por sistema se entiende un objeto o conjunto de objetos que deseamos considerar. El resto, lo demás en el Universo, que no pertenece al sistema, se conoce como su "ambiente". Se consideran varios tipos de sistemas. En un sistema cerrado no entra ni sale masa, contrariamente a los sistemas abiertos donde sí puede entrar o salir masa. Un sistema cerrado es aislado si no pasa energía en cualquiera de sus formas por sus fronteras.
Previo a profundizar en este tema de la termodinamica, es imprescindible establecer una clara distinción entre tres conceptos básicos: temperatura, calor y energía interna. Como ejemplo ilustrativo, es conveniente recurrir a la teoría cinética de los gases, en que éstos sabemos están constituidos por numerosísimas moléculas en permanente choque entre sí.
La temperatura es una medida de la energía cinética media de las moléculas individuales. El calor es una transferencia de energía, como energía térmica, de un objeto a otro debida a una diferencia de temperatura.
La energía interna (o térmica) es la energía total de todas las moléculas del objeto, o sea incluye energía cinética de traslación, rotación y vibración de las moléculas, energía potencial en moléculas y energía potencial entre moléculas. Para mayor claridad, imaginemos dos barras calientes de un mismo material de igual masa y temperatura. Entre las dos tienen el doble de la energía interna respecto de una sola barra. Notemos que el flujo de calor entre dos objetos depende de sus temperaturas y no de cuánta energía térmica o interna tiene cada uno. El flujo de calor es siempre desde el objeto a mayor temperatura hacia el objeto a menor temperatura.
Primera Ley de la Termodinamica
Esta ley se expresa como:
Eint = Q - W
Cambio en la energía interna en el sistema = Calor agregado (Q) - Trabajo efectuado por el sistema (W)
Notar que el signo menos en el lado derecho de la ecuación se debe justamente a que W se define como el trabajo efectuado por el sistema.
Para entender esta ley, es útil imaginar un gas encerrado en un cilindro, una de cuyas tapas es un émbolo móvil y que mediante un mechero podemos agregarle calor. El cambio en la energía interna del gas estará dado por la diferencia entre el calor agregado y el trabajo que el gas hace al levantar el émbolo contra la presión atmosférica.
Segunda Ley de la Termodinamica
La primera ley nos dice que la energía se conserva. Sin embargo, podemos imaginar muchos procesos en que se conserve la energía, pero que realmente no ocurren en la naturaleza.
Si se acerca un objeto caliente a uno frío, el calor pasa del caliente al frío y nunca al revés. Si pensamos que puede ser al revés, se seguiría conservando la energía y se cumpliría la primera ley.
En la naturaleza hay procesos que suceden, pero cuyos procesos inversos no. Para explicar esta falta de reversibilidad se formuló la segunda ley de la termodinamica, que tiene dos enunciados equivalentes:
Enunciado de Kelvin - Planck : Es imposible construir una máquina térmica que, operando en un ciclo, no produzca otro efecto que la absorción de energía desde un depósito y la realización de una cantidad igual de trabajo.
Enunciado de Clausius: Es imposible construir una máquina cíclica cuyo único efecto sea la transferencia continua de energía de un objeto a otro de mayor temperatura sin la entrada de energía por trabajo.
Tercera Ley de la Termodinamica y Ley Cero
Ley Cero de la Termodinámica (de Equilibrio):
"Si dos objetos A y B están por separado en equilibrio térmico con un tercer objeto C, entonces los objetos A y B están en equilibrio térmico entre sí".
Como consecuencia de esta ley se puede afirmar que dos objetos en equilibrio térmico entre sí están a la misma temperatura y que si tienen temperaturas diferentes, no se encuentran en equilibrio térmico entre sí.
Tercera Ley de la Termodinámica.
La tercera ley tiene varios enunciados equivalentes:
"No se puede llegar al cero absoluto mediante una serie finita de procesos"
Es el calor que entra desde el "mundo exterior" lo que impide que en los experimentos se alcancen temperaturas más bajas. El cero absoluto es la temperatura teórica más baja posible y se caracteriza por la total ausencia de calor. Es la temperatura a la cual cesa el movimiento de las partículas. El cero absoluto (0 K) corresponde aproximadamente a la temperatura de - 273,16ºC. Nunca se ha alcanzado tal temperatura y la termodinámica asegura que es inalcanzable.
"La entropía de cualquier sustancia pura en equilibrio termodinámico tiende a cero a medida que la temperatura tiende a cero".
"La primera y la segunda ley de la termodinámica se pueden aplicar hasta el límite del cero absoluto, siempre y cuando en este límite las variaciones de entropía sean nulas para todo proceso reversible".
En la naturaleza hay procesos que suceden, pero cuyos procesos inversos no. Para explicar esta falta de reversibilidad se formuló la segunda ley de la termodinamica, que tiene dos enunciados equivalentes:
Enunciado de Kelvin - Planck : Es imposible construir una máquina térmica que, operando en un ciclo, no produzca otro efecto que la absorción de energía desde un depósito y la realización de una cantidad igual de trabajo.
Enunciado de Clausius: Es imposible construir una máquina cíclica cuyo único efecto sea la transferencia continua de energía de un objeto a otro de mayor temperatura sin la entrada de energía por trabajo.
Tercera Ley de la Termodinamica y Ley Cero
Ley Cero de la Termodinámica (de Equilibrio):
"Si dos objetos A y B están por separado en equilibrio térmico con un tercer objeto C, entonces los objetos A y B están en equilibrio térmico entre sí".
Como consecuencia de esta ley se puede afirmar que dos objetos en equilibrio térmico entre sí están a la misma temperatura y que si tienen temperaturas diferentes, no se encuentran en equilibrio térmico entre sí.
Tercera Ley de la Termodinámica.
La tercera ley tiene varios enunciados equivalentes:
"No se puede llegar al cero absoluto mediante una serie finita de procesos"
Es el calor que entra desde el "mundo exterior" lo que impide que en los experimentos se alcancen temperaturas más bajas. El cero absoluto es la temperatura teórica más baja posible y se caracteriza por la total ausencia de calor. Es la temperatura a la cual cesa el movimiento de las partículas. El cero absoluto (0 K) corresponde aproximadamente a la temperatura de - 273,16ºC. Nunca se ha alcanzado tal temperatura y la termodinámica asegura que es inalcanzable.
"La entropía de cualquier sustancia pura en equilibrio termodinámico tiende a cero a medida que la temperatura tiende a cero".
"La primera y la segunda ley de la termodinámica se pueden aplicar hasta el límite del cero absoluto, siempre y cuando en este límite las variaciones de entropía sean nulas para todo proceso reversible".
Fuente:
http://jfinternational.com/mf/termodinamica.html
http://www.jfinternational.com/mf/tercera-ley-termodinamica.html
¿Qué fue de la energía libre?
La energía ni se crea ni se destruye, solo se transforma. Eso dice la primera ley de la termodinámica, uno de los pilares de nuestra física y nuestra ciencia actual. Sin embargo, desde hace ya bastante tiempo diversos colectivos investigadores se empeñan en tratar de descubrir un proceso de obtención de energía que, oponiendose a este principio básico, generara energía de la nada o con muy poco aporte energético. Es lo que se conoce como Energía Libre y, de ser cierta, tendría unas implicaciones brutales para nuestra economía y nuestra sociedad. La energía pasaría a carecer de valor. Sería limpia, nuestros problemas con el ecosistema cesarían, al menos en lo que tiene que ver con nuestro defectuoso sistema energético.
Muchos imperios, lobbys económicos y hasta naciones se desplomarían.
La energía libre o energía del punto cero ha sido un sueño para muchos. La ciencia oficial se ha encargado de pisotearlo, sin falta de razon en muchas ocasiones. Sin embargo no es un sueño muerto.
La energía ni se crea ni se destruye, solo se transforma. Eso dice la primera ley de la termodinámica, uno de los pilares de nuestra física y nuestra ciencia actual. Sin embargo, desde hace ya bastante tiempo diversos colectivos investigadores se empeñan en tratar de descubrir un proceso de obtención de energía que, oponiendose a este principio básico, generara energía de la nada o con muy poco aporte energético. Es lo que se conoce como Energía Libre y, de ser cierta, tendría unas implicaciones brutales para nuestra economía y nuestra sociedad. La energía pasaría a carecer de valor. Sería limpia, nuestros problemas con el ecosistema cesarían, al menos en lo que tiene que ver con nuestro defectuoso sistema energético.
Muchos imperios, lobbys económicos y hasta naciones se desplomarían.
La energía libre o energía del punto cero ha sido un sueño para muchos. La ciencia oficial se ha encargado de pisotearlo, sin falta de razon en muchas ocasiones. Sin embargo no es un sueño muerto.
Recientemente una compañía irlandesa, ubicada en Dublin, ha lanzado a través de internet la noticia de que disponen de un sistema de energía libre, basado en campos magnéticos, capaz de producir energía de forma limpia y barata- La companía se llama Steorn y su prototipo es llamado Orbo. Steorn había sido una empresa dedicada a desarrollar tecnología que ayudara a evitar el fraude en soportes digitales (tarjetas de crédito, discos ópticos, etc) alcanzado gran reputación en su apoyo a la ley en la lucha contra el crimen. Con esta reputación a sus espaldas Steorn decidió seguir desarrollando tecnología pero en una nueva linea de trabajo. Así descubrieron Orbo.
Orbo, en palabras de Steorn, produce energía libre, limpia y constante. Libre por que genera energía sin recurrir a ninguna fuente externa (violando el primer principio de la termodinámica), limpia por que durante la producción de energía no se producen emisiones de ningún tipo y costante por que, a menos que se produzca un fallo mecánico, la máquina podría producir energía de forma indefinida. Esa es la afirmación de Steorn.
Debido a la naturaleza de estas afirmaciones en agosto de 2006 Steorn lanzó un desafió a la comunidad científica, instando a que se produjera un proceso de validación, que actualmente está en desarrollo y presumiblemente concluirá a finales de 2007.
Naturalmente hay que ser cuidadoso y prudente. Pero desde luego abierto y no dejar de dar oportunidades a nuevos sistemas de pensamiento que ofrezcan posibilidadedes de cambio tan radicales. Como reza una frase que acompaña a Steorn en casi todas sus presentaciones “A menudo un gran verdad comienza con una blasfemia”.
Orbo, en palabras de Steorn, produce energía libre, limpia y constante. Libre por que genera energía sin recurrir a ninguna fuente externa (violando el primer principio de la termodinámica), limpia por que durante la producción de energía no se producen emisiones de ningún tipo y costante por que, a menos que se produzca un fallo mecánico, la máquina podría producir energía de forma indefinida. Esa es la afirmación de Steorn.
Debido a la naturaleza de estas afirmaciones en agosto de 2006 Steorn lanzó un desafió a la comunidad científica, instando a que se produjera un proceso de validación, que actualmente está en desarrollo y presumiblemente concluirá a finales de 2007.
Naturalmente hay que ser cuidadoso y prudente. Pero desde luego abierto y no dejar de dar oportunidades a nuevos sistemas de pensamiento que ofrezcan posibilidadedes de cambio tan radicales. Como reza una frase que acompaña a Steorn en casi todas sus presentaciones “A menudo un gran verdad comienza con una blasfemia”.
TRANSFERENCIA DE CALOR O TRNSMISION DE CALOR
La transferencia de calor es el paso de energía térmica desde un cuerpo de mayor temperatura a otro de menor temperatura. Cuando un cuerpo, por ejemplo, un objeto sólido o un fluido, está a una temperatura diferente de la de su entorno u otro cuerpo, la transferencia de energía térmica, también conocida como transferencia de calor o intercambio de calor, ocurre de tal manera que el cuerpo y su entorno alcancen equilibrio térmico. La transferencia de calor siempre ocurre desde un cuerpo más caliente a uno más frío, como resultado del segundo principio de la termodinámica. Cuando existe una diferencia de temperatura entre dos objetos en proximidad uno del otro, la transferencia de calor no puede ser detenida; solo puede hacerse más lenta.
Modos de transferencia
Los modos de transferencia son diferentes procesos de transporte de calor, usualmente se agrupan en tres tipos según haya también transferencia o no transferencia de materia (o fotones)como los siguientes :
- Conducción: Es la transferencia de calor que se produce a través de un medio estacionario -que puede ser un sólido- cuando existe una diferencia de temperatura.
- Convección: Se caracteriza porque se produce por medio de un fluido (líquido o gas) que transporta el calor entre zonas con diferentes temperaturas. La convección se produce únicamente por medio de materiales fluidos. Lo que se llama convección en sí, es el transporte de calor por medio del movimiento del fluido, por ejemplo: al trasegar el fluido por medio de bombas o al calentar agua en una cacerola, la que está en contacto con la parte de abajo de la cacerola se mueve hacia arriba, mientras que el agua que está en la superficie, desciende, ocupando el lugar que dejó la cacerola caliente.
- Radiación: se puede atribuir a cambios en las configuraciones electrónicas de los átomos o moléculas constitutivas. En ausencia de un medio, existe una transferencia neta de calor por radiación entre dos superficies a diferentes temperaturas, debido a que todas las superficies con temperatura finita emiten energía en forma de ondas electromagnéticas.1
Aislamiento y barreras de radiación
Los aislantes térmicos son materiales específicamente diseñados para reducir el flujo de calor limitando la conducción, convección o ambos. Las barreras de radiación, son materiales que reflejan la radiación, reduciendo así el flujo de calor de fuentes de radiación térmica. Los buenos aislantes no son necesariamente buenas barreras de radiación, y viceversa. Los metales, por ejemplo, son excelentes reflectores pero muy malos aislantes.
La efectividad de un aislante está indicado por su resistencia (R). La resistencia de un material es el inverso delcoeficiente de conductividad térmica (k) multiplicado por el grosor (d) del aislante. Las unidades para la resistencia son en el sistema internacional de unidades: (K·m²/W).
La fibra de vidrio rígida, un material aislante usado comúnmente, tiene un valor R de 4 por pulgada, mientras que el cemento, un mal conductor, tiene un valor de 0.08 por pulgada.2
La efectividad de una barrera de radiación está indicado por su reflectividad, la cual es una fracción de la radiación reflejada. Un material con una alta reflectividad (en una longitud de onda) tiene una baja absorbitividad, y por consiguiente una baja emisividad. Un reflector ideal tiene un coeficiente de reflectividad igual a 1, lo que significa que refleja el 100% de la radiación entrante. Por otro lado, en el caso de un cuerpo negro, el cual tiene una excelente absorbitividad y emitividad de la radiación térmica, su coeficiente de reflectividad es casi 0. Las barreras de radiación tiene una gran aplicación en ingeniería aeroespacial; la gran mayoría de los satélites usan varias capas aislantes aluminizadas que reflejan la luz solar, lo que permite reducir la transferencia de calor y controlar la temperatura del satélite.
Disciplinas académicas
Los fenómenos de transferencia son generalmente parte del programa de estudios de ingeniería aeroespacial,ingeniería electromecánica, ingeniería industrial, ingeniería química, ingeniería agrícola o ingeniería mecánica. Comúnmente, los conocimientos sobre termodinámica son una condición previa para el estudio de la transmisión de calor, dado que las leyes de la termodinámica son esenciales para comprender el mecanismo de la transferencia de calor. Otras disciplinas relacionadas con la transmisión de calor incluyen la conversión de energía, termofluidos y transferencia de materia.


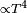 y la convección
y la convección 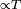 .
.

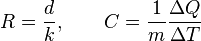

No hay comentarios.:
Publicar un comentario