El calor se define como la transferencia de energía térmica que se da entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintastemperaturas, sin embargo en termodinámica generalmente el término calor significa transferencia de energía. Este flujo de energía siempre ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor temperatura, ocurriendo la transferencia hasta que ambos cuerpos se encuentren en equilibrio térmico (ejemplo: una bebida fría dejada en una habitación se entibia).
La energía calórica o térmica puede ser transferida por diferentes mecanismos de transferencia, estos son la radiación, la conduccióny la convección, aunque en la mayoría de los procesos reales todos se encuentran presentes en mayor o menor grado. Cabe resaltar que los cuerpos no tienen calor, sino energía térmica. La energía existe en varias formas. En este caso nos enfocamos en el calor, que es el proceso mediante el cual la energía se puede transferir de un sistema a otro como resultado de la diferencia de temperatura.
Historia del concepto
Hasta el siglo XIX se explicaba el efecto del ambiente en la variación de la temperatura de un cuerpo por medio de un fluido invisible llamado calórico. Este se producía cuando algo se quemaba y, además, que podía pasar de un cuerpo a otro. La teoría del calóricoafirmaba que una sustancia con mayor temperatura que otra, necesariamente, poseía mayor cantidad de calórico.
Benjamin Thompson y James Prescott Joule establecieron que eltrabajo podía convertirse en calor o en un incremento de la energía térmica determinando que, simplemente, era otra forma de la energía.
Calor específico
El calor específico es la energía necesaria para elevar 1 °C latemperatura de un gramo de materia. El concepto de capacidad calorífica es análogo al anterior pero para una masa de un mol de sustancia (en este caso es necesario conocer la estructura químicade la misma).
El calor específico es un parámetro que depende del material y relaciona el calor que se proporciona a una masa determinada de una sustancia con el incremento de temperatura:
donde:
 es el calor aportado al sistema.
es el calor aportado al sistema. es la masa del sistema.
es la masa del sistema. es el calor específico del sistema.
es el calor específico del sistema.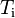 y
y 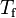 son las temperaturas inicial y final del sistema respectivamente.
son las temperaturas inicial y final del sistema respectivamente. es el diferencial de temperatura.
es el diferencial de temperatura.
Las unidades más habituales de calor específico son J / (kg · K) ycal / (g · °C).
El calor específico de un material depende de su temperatura; no obstante, en muchos procesos termodinámicos su variación es tan pequeña que puede considerarse que el calor específico es constante. Asimismo, también se diferencia del proceso que se lleve a cabo, distinguiéndose especialmente el "calor específico a presión constante" (en un proceso isobárico) y "calor específico a volumen constante (en un proceso isocórico).
De esta forma, y recordando la definición de caloría, se tiene que elcalor específico del agua es aproximadamente:
Calor específico molar
El calor específico de una sustancia está relacionado su constitución molecular interna, y a menudo da información valiosa de los detalles de su ordenación molecular y de las fuerzas intermoleculares. A altas temperaturas la mayoría de sólidos tienen capacidades caloríficas molares del orden de  (ver Ley de Dulong-Petit, siendo
(ver Ley de Dulong-Petit, siendo 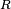 la constante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a
la constante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a  y difiere de la de gases diatómicos
y difiere de la de gases diatómicos  . En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
. En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
 (ver Ley de Dulong-Petit, siendo
(ver Ley de Dulong-Petit, siendo 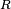 la constante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a
la constante universal de los gases ideales) mientras que la de los gases monoatómicos tiende a  y difiere de la de gases diatómicos
y difiere de la de gases diatómicos  . En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
. En este sentido, con frecuencia es muy útil hablar de calor específico molar denotado por cm, y definido como la cantidad de energía necesaria para elevar la temperatura de un mol de una sustancia en 1 grado es decir, está definida por:
donde n indica la cantidad de moles en la sustancia presente. Esta capacidad usualmente es función de la temperatura  .
.
 .
.Capacidad calorífica
La capacidad calorífica de una sustancia es una magnitud que indica la mayor o menor dificultad que presenta dicha sustancia para experimentar cambios de temperatura bajo el suministro de calor. Se denota por 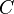 , se acostumbra a medir en J/K, y se define como:
, se acostumbra a medir en J/K, y se define como:
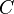 , se acostumbra a medir en J/K, y se define como:
, se acostumbra a medir en J/K, y se define como:
Dado que:
De igual forma se puede definir la capacidad calórica molar como:
Cambios de fase
En la naturaleza existen tres estados usuales de la materia: sólido,líquido y gaseoso. Al aplicarle calor a una sustancia, ésta puede cambiar de un estado a otro. A estos procesos se les conoce comocambios de fase. Los posibles cambios de fase son:
- de estado sólido a líquido, llamado fusión,
- de estado líquido a sólido, llamado solidificación,
- de estado líquido a gaseoso, llamado evaporación ovaporización,
- de estado gaseoso a líquido, llamado condensación,
- de estado sólido a gaseoso, llamado sublimación progresiva,
- de estado gaseoso a sólido, llamado sublimación regresiva o deposición,
- de estado gaseoso a plasma, llamado ionización.
- de estado plasma a gaseoso, llamado Desionización
Calor latente
Un cuerpo sólido puede estar en equilibrio térmico con un líquidoo un gas a cualquiertemperatura, o que un líquido y un gas pueden estar en equilibrio térmico entre sí, en una amplia gama de temperaturas, ya que se trata desustancias diferentes. Pero lo que es menos evidente es que dos fases o estados de agregación, distintas de una misma sustancia, puedan estar en equilibrio térmico entre sí en circunstancias apropiadas.
Un sistema que consiste en formas sólida y líquida de determinada sustancia, a una presión constante dada, puede estar en equilibrio térmico, pero únicamente a una temperatura llamada punto de fusión simbolizado a veces como 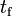 . A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latentede fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por
. A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latentede fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por  .
.
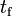 . A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latentede fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por
. A esta temperatura, se necesita cierta cantidad de calor para poder fundir cierta cantidad del material sólido, pero sin que haya un cambio significativo en su temperatura. A esta cantidad de energía se le llama calor de fusión, calor latentede fusión o entalpía de fusión, y varía según las diferentes sustancias. Se denota por  .
.
El calor de fusión representa la energía necesaria para deshacer la fase sólida que está estrechamente unida y convertirla en líquido. Para convertir líquido en sólido se necesita la misma cantidad de energía, por ello el calor de fusión representa la energía necesaria para cambiar del estado sólido a líquido, y también para pasar del estado líquido a sólido.
El calor de fusión se mide en cal / g.
De manera similar, un líquido y un vapor de una misma sustancia pueden estar en equilibrio térmico a una temperatura llamada punto de ebullición simbolizado por  . El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición o entalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por
. El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición o entalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por 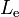 .
.
 . El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición o entalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por
. El calor necesario para evaporar una sustancia en estado líquido ( o condensar una sustancia en estado de vapor ) se llama calor de ebullición o calor latente de ebullición o entalpía de ebullición, y se mide en las mismas unidades que el calor latente de fusión. Se denota por 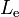 .
.
En la siguiente tabla se muestran algunos valores de los puntos de fusión y ebullición, y entalpías de algunas sustancias:
| sustancias | 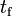 [°C] [°C] |  [cal/g] [cal/g] |  [°C] [°C] | 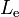 [cal/g] [cal/g] |
| H2O | 0,00 | 79,71 | 100,00 | 539,60 |
| O2 | -219,00 | 3,30 | -182,90 | 50,90 |
| Hg | -39,00 | 2,82 | 357,00 | 65,00 |
| Cu | 1083,00 | 42,00 | 2566,90 |
Transmisión de calor
El calor puede ser transmitido de tres formas distintas: por conducción, por convección o por radiación.
- Conducción térmica: es el proceso que se produce por contacto térmico entre dos ó más cuerpos, debido al contacto directo entre las partículas individuales de los cuerpos que están a diferentes temperaturas, lo que produce que las partículas lleguen al equilibrio térmico. Ej: cuchara metálica en la taza de té.
- Convección térmica: sólo se produce en fluidos (líquidos o gases), ya que implica movimiento de volúmenes de fluido de regiones que están a una temperatura, a regiones que están a otra temperatura. El transporte de calor está inseparablemente ligado al movimiento del propio medio. Ej.: los calefactores dentro de la casa.
- Radiación térmica: es el proceso por el cual se transmite a través de ondas electromagnéticas. Implica doble transformación de la energía para llegar al cuerpo al que se va a propagar: primero de energía térmica a radiante y luego viceversa. Ej.: La energía solar.
La conducción pura se presenta sólo en materiales sólidos. La convección siempre está acompañada de la conducción, debido al contacto directo entre partículas de distinta temperatura en un líquido o gas en movimiento. En el caso de la conducción, la temperatura de calentamiento depende del tipo de material, de la sección del cuerpo y del largo del cuerpo. Esto explica por qué algunos cuerpos se calientan más rápido que otros a pesar de tener exactamente la misma forma, y que se les entregue la misma cantidad de calor.
- Conductividad térmica
La conductividad térmica de un cuerpo está dada por:
donde:
 es el calor entregado,
es el calor entregado,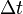 es el intervalo de tiempo durante el cual se entregó calor,
es el intervalo de tiempo durante el cual se entregó calor,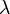 es el coeficiente de conductividad térmica propio del material en cuestión,
es el coeficiente de conductividad térmica propio del material en cuestión, es la sección del cuerpo,
es la sección del cuerpo, es la longitud, y
es la longitud, y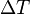 es el incremento en la temperatura.
es el incremento en la temperatura.
Medida experimental del calor
Para determinar, de manera directa, el calor que se pone de manifiesto en un proceso de laboratorio, se suele emplear uncalorímetro. En esencia, se trata de un recipiente que contiene el líquido en el que se va a estudiar la variación de energía por transferencia de calor y cuyas paredes y tapa (supuestamenteadiabáticas) deben aislarlo, al máximo, del exterior.
Un termo de paredes dobles de vidrio, cuyas superficies han sido previamente metalizadas por deposición y que presenta un espaciovacío entre ellas es, en principio, un calorímetro aceptable para una medida aproximada de la transferencia de calor que se manifiesta en una transformación tan sencilla como esta. El termo se llamavaso Dewar y lleva el nombre del físico y químico escocés James Dewar, pionero en el estudio de las bajas temperaturas. En la tapa aislante suele haber un par de orificios para introducir untermómetro con el que se evaluaría el incremento (o decremento) de la temperatura interior del líquido, y un agitador para tratar de alcanzar el equilibrio térmico en su interior lo más rápido posible, usando un sencillo mecanismo de convección forzada.
No sólo el líquido contenido en el calorímetro absorbe calor, también lo absorben las paredes del calorímetro. Lo mismo sucede cuando pierde calor. Esta intervención del calorímetro en el proceso se representa por su equivalente en agua. La presencia de esas paredes, no ideales, equivale a añadir al líquido que contiene, los gramos de agua que asignamos a la influencia del calorímetro y que llamamos "equivalente en agua". El "equivalente en agua" viene a ser "la cantidad de agua que absorbe o desprende el mismo calor que el calorímetro".
Unidades de medida[editar]
La unidad de medida del calor en el Sistema Internacional de Unidades es la misma que la de la energía y el trabajo: el Joule.
Otra unidad ampliamente utilizada para medir la cantidad de energía térmica intercambiada es la caloría (cal), que es la cantidad de energía que hay que suministrar a un gramo de agua para elevar sutemperatura 1 °C. Diferentes condiciones iniciales dan lugar a diferentes valores para la caloría. La caloría también es conocida como caloría pequeña, en comparación con la kilocaloría (kcal), que se conoce como caloría grande y es utilizada en nutrición.
Joule, tras múltiples experimentaciones en las que el movimiento de unas palas, impulsadas por un juego de pesas, se movían en el interior de un recipiente con agua, estableció el equivalente mecánico del calor, determinando el incremento de temperatura que se producía en el fluido como consecuencia de los rozamientos producidos por la agitación de las palas:
El BTU (unidad térmica británica), es una medida para el calor muy usada en Estados Unidos de América y en muchos otros países de América. Se define como la cantidad de calor que se debe agregar a una libra de agua para aumentar su temperatura en un grado Fahrenheit' y equivale a 252 calorías.
Termodinámica y transferencia de calor
La termodinámica se interesa en la cantidad de transferencia de calor a medida que un sistema pasa por un proceso, sin indicar cuánto tiempo transcurrirá. Un estudio termodinámico sencillamente nos dice cuánto calor debe transferirse para que se realice un cambio de estado específico, con el fin de cumplir con el principio de conservación de la energía. En la experiencia nos enfocamos más en la velocidad de la transferencia de calor que en la cantidad transferida. La termodinámica trata de los estados en equilibrio y de los cambios que ocurren entre un estado de equilibrio y otro. Por otra parte, la transferencia de calor se ocupa de los sistemas en los que se presenta desequilibrio térmico y, por tanto, existe una condición de no equilibrio. En consecuencia, el estudio de la transferencia de calor no puede basarse sólo en los principios de la termodinámica; sin embargo, existen leyes de la termodinámica que constituyen la base científica de la transferencia de calor.
La primera ley de la termodinámica establece que la velocidad de transferencia de energía hacia un sistema es igual a la velocidad de incremento de la energía de dicho sistema. Su segunda ley, establece que el calor se transfiere en dirección de la temperatura decreciente. El requisito básico para la transferencia de calor es la presencia de una diferencia de temperatura. No existe la más mínima posibilidad de que se dé transferencia neta de calor entre dos medios que están a la misma temperatura, esta diferencia de temperaturas constituye la condición básica necesaria para que se dé transferencia de calor.
Anteriormente mencionamos que el análisis termodinámico no se ocupa de la velocidad de la transferencia de calor en cierta dirección pero, ahora, podemos decir que este parámetro depende de la magnitud del gradiente de temperatura (o diferencia de temperatura por unidad de longitud, o la razón o relación de cambio de la temperatura en esa dirección). A mayor gradiente de temperatura, mayor es la velocidad de transferencia de calor.
Áreas de aplicación de la transferencia de calor
Es común encontrar la transmisión de calor en los sistemas de ingeniería y otros aspectos de la vida; y no es necesario ir muy lejos para ver algunas de sus áreas de aplicación. Es más, uno de los ejemplos más sencillos lo encontramos dentro del cuerpo humano, éste permanece emitiendo calor en forma constante hacia sus alrededores y la comunidad humana está íntimamente influenciada por la velocidad de esta emisión de calor. Tratamos de controlar la velocidad de esta transferencia de calor al ajustar nuestra ropa a las condiciones ambientales. Muchos aparatos domésticos se han diseñado, en su totalidad o en parte, aplicando los principios de la transferencia de calor. Algunos ejemplos incluyen la estufa eléctrica o de gas, el sistema de calefacción o de acondicionamiento del aire. La transferencia de calor desempeña un papel importante en el diseño de muchos otros aparatos, como los radiadores de automóviles, los colectores solares, diversos componentes de las plantas generadoras de energía e, incluso, las naves espaciales.
Transferencia de calor en la ingeniería
Los problemas de capacidad nominal se ocupan de la determinación de la velocidad de transferencia de calor para un sistema existente con una diferencia específica de temperatura. Los problemas de dimensionamiento se ocupan de la determinación del tamaño de un sistema con el fin de transferir calor a una velocidad determinada para una diferencia específica de la temperatura. Un proceso o un equipo de transferencia de calor puede ser analizado de forma experimental o de forma analítica. El procedimiento experimental tiene la ventaja de tratar con el sistema físico real y, gracias a ello, la cantidad deseada se determina mediante medición, dentro de los límites del error experimental. El procedimiento analítico tiene la ventaja de que es rápido y barato, pero los resultados obtenidos dependen de la exactitud de las hipótesis e idealizaciones establecidas en el análisis. En los estudios de transferencia de calor a menudo se logra una buena aproximación reduciendo, mediante el análisis, las opciones a solo unas cuantas y, a continuación, verificando los hallazgos experimentalmente.
Sensación de calor en el ser humano
Generalmente en la mayoría de los países, se habla ya de calor cuando la temperatura supera los 26 ºC en cualquier hora del día, aunque varía mucho según la estación del año en que se encuentre una persona. Por ejemplo, 20 ºC en verano es considerado una temperatura fresca, mientras que en invierno, esta temperatura es considerada templada o cálida.
El fenómeno "ola de calor" se da cuando las temperaturas diurnas superan los 32 ºC y las nocturnas (o al amanecer) no bajan de los 23 ºC por tres días y es común en casi todo tipo de climas en época veraniega, a excepción de los países cerca de los polos, con clima templado y polar, cuando es muy infrecuente o casi nulo, y se hace más frecuente cuando los países están más cerca de los trópicos (países con climas tropical y subtropical). Esta denominación de ola de calor no quiere decir necesariamente calor excesivo ni temperaturas inusuales para la estación; pretende alertar sobre consecuencias perjudiciales en personas o colectivos vulnerables.
El ser humano siente más calor cuando hay más humedad en el ambiente. Por ejemplo, una temperatura de 30 ºC, pero con humedad ambiental del 10 %, se sentirá como si el ambiente fuese de solo 28 ºC. Pero con humedad ambiental del 90 %, se sentirá como si el ambiente fuese de 40 ºC.
CANTIDAD DE CALOR
CANTIDAD DE CALOR
Cuando una sustancia se está fundiendo o evaporándose está absorbiendo cierta cantidad de calor llamada calor latente de fusión o calor latente de evaporación, según el caso. El calor latente, cualquiera que sea, se mantiene oculto, pero existe aunque no se manifieste un incremento en la temperatura,ya que mientras dure la fundición o la evaporación de la sustancia no se registrará variación de la misma.
Para entender estos conceptos se debe conocer muy bien la diferencia entre calor y temperatura.
En tanto el calor sensible es aquel que suministrado a una sustancia eleva su temperatura.
La experiencia ha demostrado que la cantidad de calor tomada (o cedida) por un cuerpo es directamente proporcional a su masa y al aumento (o disminución) de temperatura que experimenta.
La expresión matemática de esta relación es la ecuación calorimétrica:
Q = m·Ce·(Tf-Ti)
 En palabras más simples, la cantidad de calor recibida o cedida por un cuerpo se calcula mediante esta fórmula, en la cual m es la masa, Ce es el calor específico, Ti es la temperatura inicial y Tf la temperatura final. Por lo tanto Tf – Ti = ΔT (variación de temperatura).
En palabras más simples, la cantidad de calor recibida o cedida por un cuerpo se calcula mediante esta fórmula, en la cual m es la masa, Ce es el calor específico, Ti es la temperatura inicial y Tf la temperatura final. Por lo tanto Tf – Ti = ΔT (variación de temperatura).
Nota: La temperatura inicial (Ti) se anota también como T0 o como t0.
Si Ti > Tf el cuerpo cede calor Q < 0
Si Ti < Tf el cuerpo recibe calor Q > 0
Se define calor específico (Ce) como la cantidad de calor que hay que proporcionar a un gramo de sustancia para que eleve su temperatura en un grado centígrado. En el caso particular del agua Ce vale 1 cal/gº C ó 4,186 J.
MEDIDA DEL CALOR
De acuerdo con el principio de conservación de la energía, suponiendo que no existen pérdidas, cuando dos cuerpos a diferentes temperaturas se ponen en contacto, el calor tomado por uno de ellos ha de ser igual en cantidad al calor cedido por el otro. Para todo proceso de transferencia calorífica que se realice entre dos cuerpos puede escribirse entonces la ecuación:
Q1 = - Q2
en donde el signo - indica que en un cuerpo el calor se cede, mientras que en el otro se toma. Recurriendo a la ecuación calorimétrica, la igualdad anterior puede escribirse en la forma:
m1 · c1 · (Te - T1) = -m2 · c2 · (Te - T2)
(6)
donde el subíndice 1 hace referencia al cuerpo frío y el subíndice 2 al caliente. La temperatura Te en el equilibrio será superior a T1 e inferior a T2.
La anterior ecuación indica que si se conocen los valores del calor específico, midiendo temperaturas y masas, es posible determinar cantidades de calor. El aparato que se utiliza para ello se denomina calorímetro. Un calorímetro ordinario consta de un recipiente de vidrio aislado térmicamente del exterior por un material apropiado. Una tapa cierra el conjunto y dos pequeños orificios realizados sobre ella dan paso al termómetro y al agitador, los cuales se sumergen en un líquido llamado calorimétrico, que es generalmente agua.
Cuando un cuerpo a diferente temperatura que la del agua se sumerge en ella y se cierra el calorímetro, se produce una cesión de calor entre ambos hasta que se alcanza el equilibrio térmico. El termómetro permite leer las temperaturas inicial y final del agua y con un ligero movimiento del agitador se consigue una temperatura uniforme. Conociendo el calor específico y la masa del agua utilizada, mediante la ecuación calorimétrica se puede determinar la cantidad de calor cedida o absorbida por el agua.
En este tipo de medidas han de tomarse las debidas precauciones para que el intercambio de calor en el calorímetro se realice en condiciones de suficiente aislamiento térmico. Si las pérdidas son considerables no será posible aplicar la ecuación de conservación Q1 = - Q2 y si ésta se utiliza los resultados estarán afectados de un importante error.
La ecuación (6) puede aplicarse únicamente a aquellos casos en los cuales el calentamiento o el enfriamiento del cuerpo problema no lleva consigo cambios de estado físico (de sólido a líquido o viceversa, por ejemplo). A partir de ella y con la ayuda del calorímetro es posible determinar también el calor específico del cuerpo si se conocen las temperaturas T1, T2 y Te, las masas m1 y m2 y el calor específico del agua.
Unidades de calor
LA ECUACIÓN CALORIMÉTRICA (1) SIRVE PARA DETERMINAR CANTIDADES DE CALOR SI SE CONOCE LA MASA DEL CUERPO, SU CALOR ESPECÍFICO Y LA DIFERENCIA DE TEMPERATURA, PERO ADEMÁS PERMITE DEFINIR LA CALORÍA COMO UNIDAD DE CALOR. SI POR CONVENIO SE TOMA EL AGUA LÍQUIDA COMO SUSTANCIA DE REFERENCIA ASIGNANDO A SU CALOR ESPECÍFICO UN VALOR UNIDAD, LA CALORÍA RESULTA DE HACER UNO EL RESTO DE LAS VARIABLES QUE INTERVIENEN EN DICHA ECUACIÓN.
Una caloría es la cantidad de calor necesaria para elevar en un grado centígrado (1 ºC) la temperatura de un gramo de agua.
Esta definición, que tiene su origen en la época en la que la teoría del calórico estaba en plena vigencia, se puede hacer más precisa si se considera el hecho de que el calor específico del agua varía con la temperatura. En tal caso la elevación de un grado centígrado a la que hace referencia la anterior definición ha de producirse entre 14,5 y 15,5 ºC a la presión atmosférica.
Una vez identificado el calor como una forma de energía y no como un fluido singular, la distinción entre unidades de calor y unidades de energía perdió significado. Así, la unidad de calor en el SI coincide con la de energía y es el joule (J), habiendo quedado la caloría reducida a una unidad práctica que se ha mantenido por razones históricas, pero que va siendo progresivamente desplazada por el joule.
La ecuación calorimétrica
La experiencia pone de manifiesto que la cantidad de calor tomada (o cedida) por un cuerpo es directamente proporcional a su masa y al aumento (o disminución) de temperatura que experimenta. La expresión matemática de esta relación es la ecuación calorimétrica.
Q = c · m · (Tf - Ti) (1)
donde Q representa el calor cedido o absorbido, m la masa del cuerpo y Tf y Ti las temperaturas final e inicial respectivamente. Q será positivo si la temperatura final es mayor que la inicial (Tf > Ti) y negativo en el caso contrario (Tf < Ti). La letra crepresenta la constante de proporcionalidad correspondiente y su valor es característico del tipo de sustancia que constituye el cuerpo en cuestión. Dicha constante se denomina calor específico. Su significado puede deducirse de la ecuación (1). Si se despeja c, de ella resulta:
El calor específico de una sustancia equivale, por tanto, a una cantidad de calor por unidad de masa y de temperatura; o en otros términos, es el calor que debe suministrarse a la unidad de masa de una sustancia dada para elevar su temperatura un grado.
El calor específico
El calor específico puede deducirse de la ecuación:
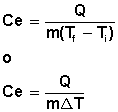
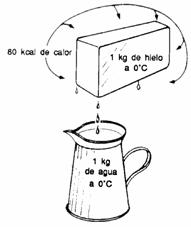 |
| Si a 1 kg de hielo (a 0º C) le aplicamos 80 kcal obtendremos 1 kg de agua a 0º C. |
Calor latente de fusión
Para que un sólido pase al estado líquido debe absorber la energía necesaria a fin de destruir las uniones entre sus moléculas. Por lo tanto, mientras dura la fusión no aumenta la temperatura. Por ejemplo, para fundir el hielo o congelar el agua sin cambio en la temperatura, se requiere un intercambio de 80 calorías por gramo, o 80 kilocalorías por kilogramo.
El calor requerido para este cambio en el estado físico del agua sin que exista variación en la temperatura recibe el nombre de calor latente de fusión o simplemente calor de fusión del agua.
Esto significa que si sacamos de un congelador cuya temperatura es de –6° C un pedazo de hielo de masa igual a 100 gramos y lo ponemos a la intemperie, el calor existente en el ambiente elevará la temperatura del hielo, y al llegar a 0° C y seguir recibiendo calor se comenzará a fundir.
A partir de ese momento todo el calor recibido servirá para que la masa de hielo se transforme en agua líquida. Como requiere de 80 calorías por cada gramo (ver cuadro), necesitará recibir 8.000 calorías del ambiente para fundirse completamente. Cuando esto suceda, el agua se encontrará aún a 0° C y su temperatura se incrementará sólo si se continúa recibiendo calor, hasta igualar su temperatura con el ambiente.
Calor de fusión de cada sustancia
El calor de fusión es una propiedad característica de cada sustancia, pues según el material de que esté hecho el sólido requerirá cierta cantidad de calor para fundirse. Por definición: el calor latente de fusión de una sustancia es la cantidad de calor que requiera ésta para cambiar 1 gramo de sólido a 1 gramo de líquido sin variar su temperatura.
Los cálculos pertinentes se realizan utilizando las fórmulas:
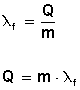
Donde λf = calor latente de fusión en cal/gramo.
Q = calor suministrado en calorías.
m = masa de la sustancia en gramos.
En el cuadro siguiente se dan algunos valores del calor latente de fusión para diferentes sustancias.
Sustancia λf en cal/gr.
Agua 80
Hierro 6
Cobre 42
Plata 21
Platino 27
Oro 16
Mercurio 2,8
Plomo 5,9
Agua 80
Hierro 6
Cobre 42
Plata 21
Platino 27
Oro 16
Mercurio 2,8
Plomo 5,9
Equilibro térmico
Es el estado en el que se igualan las temperaturas de dos cuerpos que inicialmente tenían diferentes temperaturas. Al igualarse las temperaturas se suspende el flujo de calor, y el sistema formados por esos cuerpos llega a su equilibrio térmico.
Por ejemplo, si pone tienes un recipiente con agua caliente, y otro con agua fría, a través de sus paredes se establecera un flujo de energía calorífica, pasado un tiempo, la temperatura del agua en ambos recipientes se igualará (por obra de las tranferencias de calor, en este caso del a

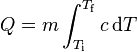

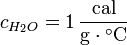

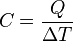
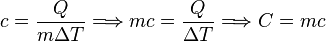



No hay comentarios.:
Publicar un comentario